Por Pedro Cassab* e Roberto Latini** | Cassab Law – Advogados – 06 de abril de 2020
Diante do Estado de Calamidade reconhecido por Ato do Congresso Nacional de 20/03/2020 através do Decreto Legislativo nº 6, de 2020 assinado pelo Senador Antônio Anastasia, a Agência Nacional de Vigilância Sanitária – ANVISA, dentre outras ações emergências necessárias ao combate do novo Coronavírus, publicou a Resolução de Diretoria Colegiada – RDC nº 346, de 12 de março de 2020 a qual define os critérios e os procedimentos extraordinários e temporários para a certificação de boas práticas de fabricação para fins de registro e alterações pós-registro de insumo farmacêutico ativo, medicamento e produtos para saúde em virtude da emergência de saúde pública internacional do novo Coronavírus, tema já abordado anteriormente.
Ao Setor Regulado de Saúde impõe especial atenção ao fato de que:
I – a abrangência da RDC 346/2020 não se limita as certificações de medicamentos ou produtos para saúde dedicados ao tratamento do novo Coronavirus;
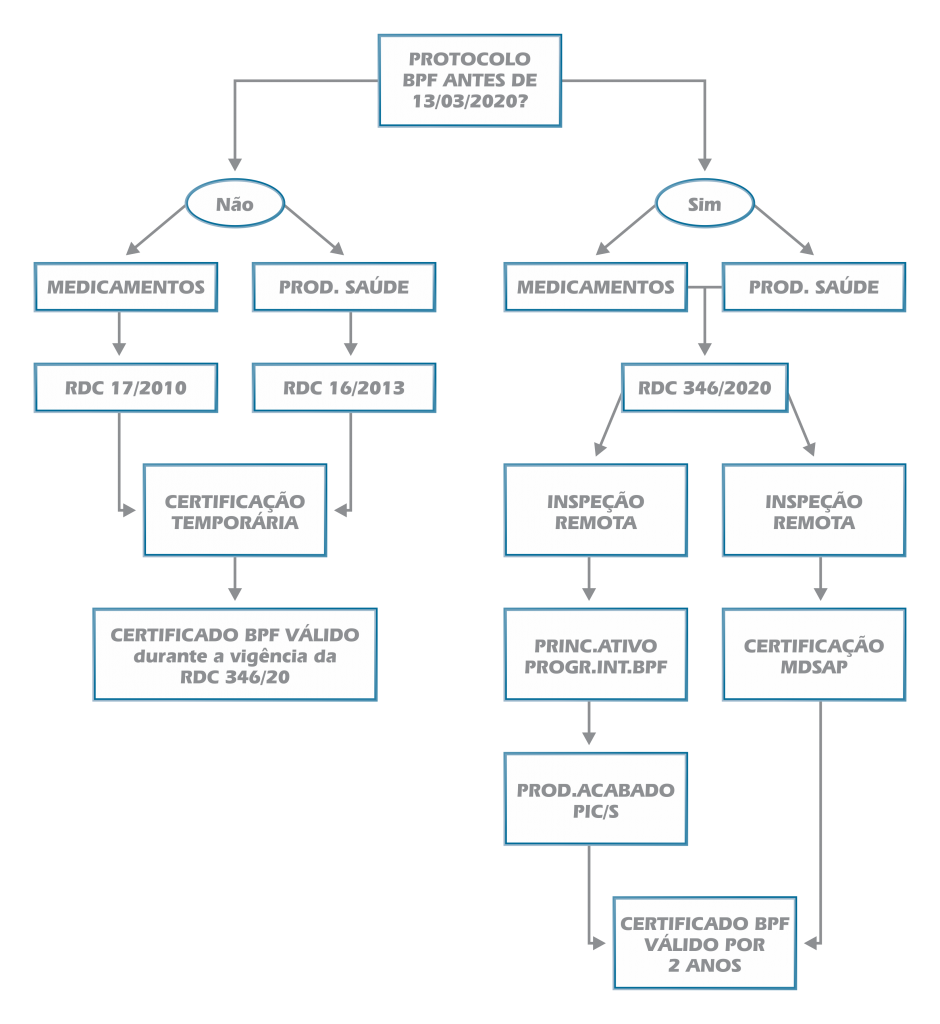
II – para petições protocoladas antes de 13/03/2020 fica permitida para fins de certificação das boas práticas de fabricação a utilização temporária e emergencial de informações provenientes de Autoridades Regulatórias Estrangeiras em substituição às inspeções sanitárias realizadas pela Anvisa para fins de Certificação de Boas Práticas de Fabricação com exceção aos casos em que quando a última inspeção realizada pela Anvisa tenha sido considerado o estabelecimento como inapto ao fornecimento de produtos ao mercado brasileiro;
III – para petições protocoladas antes de 13/03/2020 fica permitida a possibilidade de inspeções remotas;
IV – Certificação Temporária para medicamento ou produto para saúde quando comprovados três requisitos:
a. medicamento ou produto de saúde utilizados em casos de grave risco à saúde destinados ao controle, diagnóstico, prevenção ou tratamento para atender às necessidades de saúde causada pelo novo Coronavírus;
b. produto essencial para manutenção da vida cuja disponibilidade esteja ameaçada por desabastecimento (iminente ou instalado) no mercado nacional motivado por razão comprovadamente ligada ao novo Coronavírus;
c. a certificação em Boas Práticas de Fabricação for o único impedimento ao registro sanitário e à comercialização do produto.
Portanto, numa análise mais atenta da norma, a conclusão que se pode chegar é que, apesar das exceções previstas no texto normativo, a Certificação Temporária, só será realizada nos casos em que a certificação de boas práticas de fabricação:
I – não possa ser realizada pelos mecanismos alternativos descritos na Resolução – RDC 346/2020;
II – não tenha sido considerado, o estabelecimento, inapto ao fornecimento de produtos ao mercado brasileiro.
Assim, diante do estado de calamidade decretado, se pode concluir que as petições submetidas para certificação das para boas práticas de fabricação de medicamentos ou produtos para saúde protocolada antes de 13/03/2020 fazem jus aos meios alternativos de inspeção remota previstos na Resolução RDC 346/2020 para certificação das boras boas práticas de fabricação não devendo restar dúvida, portanto, sobre a abrangência e finalidade da norma a qual deve, ainda que diante do atual cenário, assegurar, como regra, o Livre Exercício de Atividade Econômica das empresas submetidas ao Regime de Vigilância Sanitária com o único fim de evitar o desabastecimento do mercado de saúde seja ou não produtos destinados ao controle, diagnóstico, prevenção ou tratamento do novo Coronavirus (SARS-CoV-2), ou seja, de todos os medicamentos e produtos para saúde cuja falta possa levar risco aos pacientes. Um ótimo exemplo disso são os medicamentos de uso contínuo, equipamentos e materiais para o monitoramento de doenças crônicas como a diabetes, hipertensão, entre outras.
FLUXOGRAMA DETALHADO DA RESOLUÇÃO DE DIRETORIA COLEGIADA – RDC Nº 346, DE 12 DE MARÇO DE 2020
*Pedro Cassab é Advogado e Sócio Fundador do escritório Cassab Law – Advogados. Graduado pela Universidade Paulista de Ribeirão Preto, Estado de São Paulo – 2001; Especialista em Direito Sanitário pela Faculdade de Ciências Médicas da Universidade Estadual de Campinas em parceria com o Instituto de Direito Sanitário Aplicado com a tese “O Poder Regulamentar da Agência Nacional de Vigilância Sanitária” – 2010; Auditor Líder (BPF/GMP) RDC 16/13 ANVISA, ISO 13485 e 21 CRF 820 – FDA/USA – 2013; Pós-Graduado em Direito Econômico e Desenvolvimento pela Faculdade de Direito de Ribeirão Preto da Universidade de São Paulo – 2016/2017; Certificado pelo Instituto de Direito Regulatório (IPDR) em Direito Regulatório Farmacêutico, São Paulo – 2018; Membro do Grupo de Estudos de Direito Sanitário (GEDISA/USP) – 2020.
** Roberto Latini é Advogado, Biomédico e Consultor com forte experiência em Assuntos Regulatórios, Compliance e Contratos Internacionais. Mais de 25 anos de atuação na área regulatória.

